Mekanisme Reaksi Adisi Elektrofilik pada
Senyawa Organik Tidak Jenuh
Reaksi adisi adalah reaksi
penggabungan dua atau lebih molekul menjadi sebuah molekul yang lebih besar
dengan disertai berkurangnya ikatan rangkap dari salah satu molekul yang
bereaksi akibat adanya penggabungan. Biasanya satu molekul yang terlibat
mempunyai ikatan rangkap. Reaksi ini hanya terjadi hidrokarbon tak jenuh
(alkena dan alkuna).
Dalam reaksi adisi, molekul
senyawa yang mempunyai ikatan rangkap menyerap atom atau gugus atom sehingga
ikatan rangkap berubah menjadi ikatan tunggal. Alkena dan alkuna dapat
mengalami reaksi adisi dengan hidrogen, halogen maupun asam halida (HX). Untuk alkena atau
alkuna, bila jumlah atom H pada kedua atom C ikatan rangkap berbeda, maka arah
adisi ditentukan oleh kaidah Markovnikov, yaitu atom H akan terikat pada atom
karbon yang lebih banyak atom H-nya (“yang kaya semakin kaya”). Pada reaksi ini
berlaku hukum Markovnikov ”Atom H dari asam halida ditangkap oleh C
berikatan rangkap yang mengikat atom H lebih banyak atau gugus
alkil yang lebih kecil.
1. REAKSI
ADISI ASAM HALIDA PADA ALKENA
Reaktivitas relatif asam halida HI > HBr > HCl > HF.
Asam terkuat HI bersifat paling reaktif terhadap alkena
Asam terlemah HF paling tak reaktif terhadap alkena.
Suatu hidrogen halida mengandung ikatan H-X yang sangat polar dan dapat
mudah melepaskan H+ dan menyerang ikatan rangkap pada alkena
dan membentuk karbokation sementara, yang dengan cepat bereaksi dengan ion
negatif halida dan menghasilkan alkil halida (R-X).
Dalam adisi ini atom X terikat
pada C rangkap dikiri atau dikanan akan menghasilkan senyawa yang berbeda,
kecuali kalau R dengan R’ sama. Untuk itu, ada aturan yang (padat) menetapkan
hasil utama dari reaksi adisi tersebut yang dikemukakan oleh Vlademir
Markovnikov. Aturan Markovnikov :
·
ikatan
rangkap merupakan kumpulan elektron
·
gugus
alkil merupakan gugus pendorong elektron. Alkil makin besar, daya dorong makin
kuat. Urutan kekuatan alkil : – CH3 < – C2H5 < – C3H7
·
gugus
elektronegatif merupakan gugus penarik elektron. Makin elektronegatif, daya
tarik elektron makin kuat
contoh :
Adisi artinya penambahan atau
penangkapan. Dalam reaksi adisi, suatu zat ditambahkan ke dalam senyawa C yang
mempunyai ikatan rangkap, sehingga ikatan rangkap itu berubah menjadi ikatan
tunggal. Reaksi adisi dibedakan atas (a) reaksi adisi elektrofilik dan (b)
reaksi adisi nukleofilik.
2. REAKSI ADISI DENGAN HALOGEN
Reaksi adisi dengan brom
digunakan untuk membedakan senyawa alkena (C = C) dengan sikloalkana. Hal ini
karena kedua senyawa mempunyai isomer fungsional (rumus molekul sama, tetapi
gugus fungsi berbeda). Pengamatan reaksinya dengan membedakan warna dari brom
yaitu merah coklat. Alkena dapat bereaksi dengan brom sehingga warna merah
coklat dari brom hilang menjadi tidak berwarna. Akan tetapi, sikloalkana tidak
bereaksi dan warna merah coklat dari brom tetap.
Alkena +
brom → bereaksi, warna merah coklat dari brom hilang
Sikloalkana + brom tidak
bereaksi, warna merah coklat dari brom tetap.
REAKSI ADISI ELEKTROFILIK
Reaksi adisi elektrofilik terjadi
apabila gugus yang pertama menyerang suatu ikatan rangkap pereaksi elektrofil.
Reaksi adisi elektrofilik ditemukan pada senyawa C yang mengandung ikatan
rangkap antara dua atom C seperti alkena dan alkuna. Contoh reaksi adisi
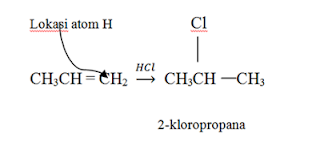
elektrofilik adalah reaksi antara etena dengan asam klorida menghasilkan
etil-klorida.
MEKANISME REAKSI ADISI
ELEKTROFILIK
Pada senyawa alkena terdapat
elektron π yang letaknya lebih jauh dari inti dibanding elektron pada ikatan σ,
sehingga lebih mudah diserang oleh suatu elektrofil. Elektron pi adalah suatu
nukleofil lemah.
Mekanisme reaksi
adisi dari air terhadap etilen, suatu alkena sederhana
Permasalahan :
1.Mengapa reaksi adisi terjadi hanya pada senyawa tak jenuh
? Apakah bisa juga terjadi pada senyawa jenuh
3.pada
artikel di atas, reaksi elektrofilik terjadi antara etena dan asam klorida
menghasilkan etil klorida,adakah contoh lain selain itu, dan bagaimana
mekanismenya?









Disini saya akan membantu menjawab permasalahan nomor 2 yaitu Apa syarat-syarat bisa terjadinya reaksi adisi?
BalasHapusBerdasarkan dari literatur yang saya baca terjadinya reaksi adisi ditandai dengan hilangnya warna merah cokelat dari bromin. Karena alkana tidak memiliki ikatan rangkap (tidak mengalami reaksi adisi) warna merah dari bromin tidak berubah. Reaksi adisi terjadi jika senyawa karbon yang mempunyai ikatan rangkap menerima atom atau gugus atom lain sehingga ikatan rangkap berubah menjadi ikatan tunggal. Ikatan rangkap merupakan ikatan tak jenuh, sedangkan ikatan tunggal merupakan ikatan jenuh. contohnya reaksi adisi pada alkena dapat terjadi pada alkena simetris dan asimetris.
saya akan membantu permasalahan Anda pada nomor 1
BalasHapuskarena Reaksi adisi ini terjadi pada senyawa tak jenuh. Dimana molekul tak jenuh dapat menerima tambahan atau gugus dari suatu pereaksi. Dua contoh pereaksi yang mengadisi pada ikatan rangkap adalah brom dan hidrogen. Adisi brom biasanya merupakan reaksi cepat, dan sering dipakai sebagai uji kualitatif untuk mengidentifikasi ikatan rangkap dua atau rangkap tiga. Dan tidak bisa bereaksi dengan senyawa jenuh karena tidak memiliki ikatan rangkap.
Saya akan membantu menjawab permasalahan no 3
BalasHapuscontoh lain dari reaksi elektrofilik adalah reaksi adisi dari air terhadap etilen. mekanismenya sebagai berikut:
Serangan elektrofil terhadap ikatan π membentuk suatu karbokation. Tahap pertama berjalan lambat, dan merupakan tahap penentu laju. Bila alkena yang bereaksi adalah propena (alkena tak simetris karena substituen yang terikat pada karbon alkena tidak sama), maka ada dua kemungkinan produk yang terbentuk karena gugus OH dapat masuk pada karbon CH2 atau karbon CH3CH. Kita dapat mengatakan bahwa produk yang terbentuk lebih cepat akan menjadi produk dominan dalam campuran. Dan kenyataannya kecepatan pembentukan produk satu 100 kali lebih cepat dibanding produk yang lain. Sehingga secara teknis praktis hanya satu produk yang dapat diamati. Dengan kata lain produk yang diramalkan adalah produk yang laju pembentukannya lebih cepat.Masalahnya adalah bila ada dua kemungkinan, kita harus bisa menentukan produk mana yang terjadi dengan laju lebih cepat. Hal ini tergantung energi aktivasi untuk mencapai keadaan teraktifkan. Reaksi dengan energi keadaan transisi lebih rendah akan berlangsung lebih cepat dan menghasilkan produk lebih melimpah. Karbokation sekunder lebih stabil (mempunyai tingkat energi lebih rendah) dibanding carbocation primer. Gugus metil bersifat pendorong elektron yang membantu stabilisasi karbokation.