Senyawa organologam adalah senyawa
di mana atom-atom karbon dari gugus organik terikat kepada atom logam. Contoh,
suatu aloksida seperti (C3H7O)4Ti tidaklah
dianggap sebagai suatu senyawa organologam karena gugus organiknya terikat pada
Ti melalui oksigen, sedangkan C6H5Ti(OC3H7)3 karena
terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam
Ti.HH Istilah organologam biasanya didefenisikan agak longgar, dan senyawaan
dari unsur-unsur seperti Boron, fosfor, dan silikon semuanya mirip logam.Tetapi
untuk senyawa yang mengandung ikatan antara atom logam dengan oksigen,
belerang, nitrogen, ataupun dengan suatu halogen tidak termasuk sebagai senyawa
organologam. Dari bentuk ikatan pada senyawa organologam, senyawa ini dapat
dikatakan sebagai jembatan antara kimia organik dan anorganik.
Sifat senyawa organologam yang umum
ialah atom karbon yang lebih elektronegatif daripada kebanyakan logamnya.
Senyawa komplek logam (biasanya logam-logam transisi) merupakan senyawa yang
memiliki satu atau lebih ikatan logam-karbon. Senyawa organologam terdiri dari
atom pusat dan ligan (Blaser et al, 2000).
Terdapat
beberapa kecenderungan jenis-jenis ikatan yang terbentuk pada senyawaan
organologam:
a. Senyawaan
ionik dari logam elektropositif
Senyawaan organo dari logam yang
relatif sangat elektropositif umumnya bersifat ionik, tidak larut dalam pelarut
organik, dan sangat reaktif terhadap udara dan air. Senyawa ini terbentuk bila
suatu radikal pada logam terikat pada logam dengan keelektropositifan yang
sangat tinggi, misalnya logam alkali atau alkali tanah. Kestabilan dan
kereaktifan senyawaan ionik ditentukan dalam satu bagian oleh kestabilan ion
karbon. Garam logam ion-ion karbon yang kestabilannya diperkuat oleh
delokalisasi elektron lebih stabil walaupun masih relatif reaktif. Adapun
contoh gugus organik dalam garam-garaman tersebut seperti (C6H5)3C-Na+ dan
(C5H5)2Ca2+.
b. Senyawaan
yang memiliki ikatan -σ (sigma)
Senyawaan
organologam dimana sisa organiknya terikat pada suatu atom logam
dengan suatu ikatan yang digolongkan sebagai ikatan kovalen (walaupun masih ada
karakter-karakter ionik dari senyawaan ini) yang dibentuk oleh kebanyakan logam
dengan keelektropositifan yang relatif lebih rendah dari golongan pertama di
atas, dan sehubungan dengan beberapa faktor berikut:
1. Kemungkinan
penggunaan orbital d yang lebih tinggi, seperti pada SiR4 yang
tidak tampak dalam CR4.
2. Kemampuan
donor alkil atau aril dengan pasangan elektron menyendiri.
3. Keasaman
Lewis sehubungan dengan kulit valensi yang tidak penuh seperti ada BR2 atau
koordinasi tak jenuh seperti ZnR2.
4. Pengaruh
perbedaan keelektronegatifan antara ikatan logam-karbon (M-C) atau
karbon-karbon (C-C).
c. Senyawaan
yang terikat secara nonklasik
Dalam banyak senyawaan organologam
terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam
bentuk ionik atau pasangan elektron/kovalensi. Misalnya, salah satu kelas alkil
terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam
hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom
Boron pada B(CH3)3. Atom B termasuk atom golongan IIIA,
dimana memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk
konfigurasi oktet dalam senyawaannya.
2.2 Konsep dasar Organologam
dan Reaksi-reaksi Pembentukan Organologam
Pada
dasarnya Organologam prinsipnya yaitu atom-atom Karbon dari gugus organik
terikat kepada atom logam. Konsep ini yang mendasari Organologam, sehingga
banyak cara untuk menghasilkan ikatan-ikatan logam pada Carbon yang berguna
bagi kedua logam transisi dan non-transisi. Beberapa yang lebih penting adalah
sebagai berikut:
1. Reaksi
Logam langsung ; sintesis yang paling awal oleh ahli kimia Inggris,
Frankland dalam tahun 1845 adalah interaksi antara Zn dan suatu
alkil Halida. Adapun yang lebih berguna adalah penemuan ahli kimia Perancis,
Grignard yang dikenal sebagai pereaksi Grignard. Contohnya interaksi Magnesium
dan alkil atau aril Halida dalam eter:
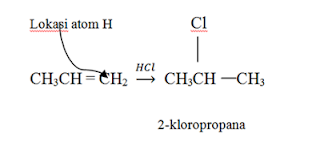
Mg + CH3I → CH3MgI
Interaksi langsung alkil atau aril
Halida juga terjadi dengan Li, Na, K, Ca, Zn dan Cd.
2. Penggunaan
zat pengalkilasi. Senyawa ini dimanfaatkan untuk membuat senyawa organologam
lainnya. Kebanyakan Halida nonlogam dan logam atau turunan Halida dapat
dialkilasi dalam eter atau pelarut hidrokarbon, misalnya :
PCl3 + 3C6H5MgCl →
P(C6H5)3 + 3MgCl2
VOCl3 + 3(CH3)3SiCH2MgCl
→ VO(CH2SiMe3)3 + 3MgCl2
3. Interaksi
Hidrida Logam atau nonlogam dengan alkena atau alkuna.
4. Reaksi
Oksidatif adisi. Reaksi yang dikenal sebagai reaksi Oksa dimana Alkil atau Aril
Halida ditambahkan pada senyawa logam transisi Koordinasi tidak jenuh
menghasilkan ikatan logam Karbon. Contohnya:
RhCl(PPh3)3 +
CH3I → RhClI(CH3)(PPh3)2 + PPh3
5. Reaksi
Insersi yaitu reaksi yang menghasilkan ikatan-ikatan dengan Karbon, sebagai
contoh:
SbCl5 + 2HC
CH→Cl3Sb(CH=CHCl)2
Atom pusat dari suatu senyawa
kompleks yang digunakan antara lain logam-logam transisi deret pertama seperti:
Cr, Mn, Fe, Co, Ni, Cu, dan Zn (HIjazi et al, 2008). Ligan dari
suatu senyawa komplek dapat mempengaruhi bentuk geometri dari senyawa
organologam itu sendiri sehingga dapat dimanfaatkan dalam berbagai reaksi
kimia. Tabel 1 menjelaskan tentang perbedaan jenis ligan yang terikat pada atom
pusat, dimana memberikan bentuk geometri yang berbeda dan perbedaan reaksi yang
mampu dikatalisisnya.
Reaksi Grignard
Reaksi Grignard
adalah reaksi kimia organologam di mana alkil - atau Aril-magnesium halides
(reagen Grignard) menambah gugus karbonil Aldehida atau keton. Reaksi ini
adalah alat penting untuk pembentukan ikatan antar karbon. Reaksi Halida
organik dengan magnesium bukan reaksi Grignard, tetapi menyediakan peraksi
Grignard. Pereaksi Grignard memiliki rumus umum RMgX dimana X adalah sebuah
halogen, dan R adalah sebuah gugus alkil atau aril (berdasarkan pada sebuah
cincin benzen). Pereaksi Grignard sederhana bisa berupa CH3CH2MgBr.
MEKANISME REAKSI
Reagen
Grignard berfungsi sebagai nukleofil, menyerang atom karbon elektrofilik yang
hadir dalam ikatan polar gugus karbonil. Penambahan pereaksi Grignard untuk
karbonil biasanya hasil melalui keadaan transisi enam-beranggota cincin.
Mekanisme dari
reaksi Grignard:
Namun, dengan
pereaksi Grignard terhalang, reaksi dapat melanjutkan dengan transfer elektron tunggal.
Jalur serupa diasumsikan untuk reaksi lain dari reagen Grignard, misalnya,
dalam pembentukan ikatan antara karbon-fosfor, timah-karbon, karbon-silikon,
boron-karbon dan karbon-heteroatom.
REAKSI-REAKSI DARI
PEREAKSI GRIGNARD
Reaksi pereaksi
Grignard dengan senyawa-senyawa karbonil
Reaksi antara
berbagai macam senyawa karbonil dengan pereaksi Grignard bisa terlihat sedikit
rumit, walaupun pada kenyataannya semua senyawa karbonil bereaksi dengan cara
yang sama – yang berbeda hanyalah gugus-gugus yang terikat pada ikatan rangkap
C=O.
Apa yang terjadi
pada reaksi ini jauh lebih mudah dipahami dengan mencermati persamaan umumnya
(menggunakan gugus "R" bukan gugus tertentu) – setelah anda memahami
dengan gugus R barulah bisa diganti dengan gugus yang sesungguhnya jika
diperlukan.
Reaksi-reaksi yang
terjadi pada dasarnya sama untuk reaksi dengan karbon dioksida – yang
membedakan hanya sifat-sifat produk organiknya.
Pada tahap pertama,
pereaksi Grignard diadisi ke ikatan rangkap C=O:
Asam encer
selanjutnya ditambahkan untuk menghidrolisisnya. (Pada persamaan berikut
digunakan persamaan umum dengan tidak mempertimbangkan fakta bahwa Mg(OH)Br
akan bereaksi lebih lanjut dengan asam yang ditambahkan.)
Alkohol terbentuk.
Salah satu kegunaan penting dari pereaksi Grignard adalah kemampuannya untuk
membuat alkohol-alkohol kompleks dengan mudah. Jenis alkohol yang dihasilkan
tergantung pada senyawa karbonil yang digunakan – dengan kata lain, gugus R dan
R’ yang dimiliki.
Permasalahan:
1.Apa saja kegunaan organologam
dalam kehidupan sehari-hari?
2. ikatan apa saja yang terjadi pada
senyawa organologam?
3.jenis ikatan apa saja yang terjadi
pada senyawa organologam?